A comienzos del siglo XIX el científico Ingles Jhon Dalton establece una teoría atómica moderna que le da valides a lo propuesto por los griegos.
Podemos resumir su pensamiento en los siguientes postulados:
1-La materia está formada por partículas indivisibles llamadas átomos.
2-Átomos de un mimo elemento son iguales entre si y diferentes a átomos de cualquier otro elemento.
3-Los compuestos o combinaciones de átomos de distintos elementos.

Este modelo fracasa por que no predice correctamente larelacion entre materia y energia.
MODELO ATOMICO DE THOMPSON:
Thompson realizo sus experiencias en tubos de descarga con haces de electrones y teniendo en cuenta los trabajos realizados por otros científicos que tuvieron en cuenta la relación y electricidad y propone un modelo:
El átomo es una esfera de densidad uniforme y carga positiva; dentro de la cual están incrustados los electrones en numero suficiente para neutralizar la carga.
Pero este modelo no predice correctamente la existencia de los enlaces químicos y como ocurren las relaciones químicas.

MODELO ATOMICO DE ERNESTO RUTHERFORD
Postulados:
1-El átomo tiene espacios vacíos.
2-El átomo consta de un núcleo donde se encuentra la carga positiva.
3-Los electrones giran alrededor del núcleo en órbitas circulares como un sistema solar en miniatura.
4-No explica o falla:
por que si los electrones se mueven en órbitas circulares se van acercando perdiendo energía hasta ser capturados por el núcleo.


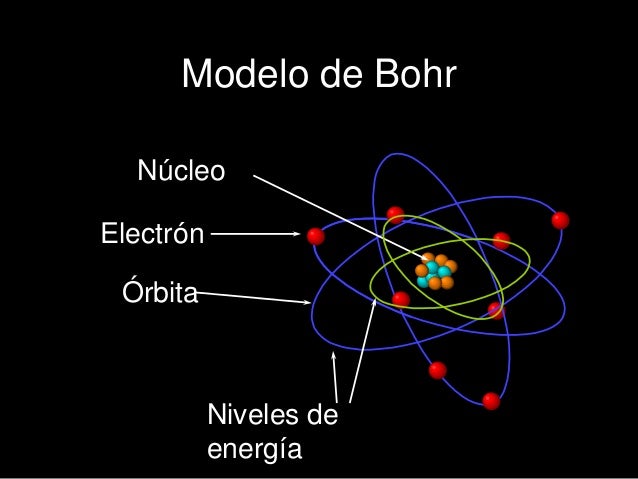
MODELO ATÓMICO DE NIELS BOHR:
Bohr propuso una teoría basada en el espectro de rayos del átomo de hidrógeno y el concepto de la teoría cuántica de Planck, para explicar la configuración electrónica de los átomos.
Postulados:
1-El átomo tiene un núcleo positivo en el cual se encuentra la mayor parte de la masa.
2.Los electrones están alrededor del núcleo con determinados valores de energía.
3- Cuando un electrón esta en un nivel de energía no gana ni pierde la misma.
4- Para pasar de un nivel a otro un electrón absorbe o emite energía en forma de un foton o quantum de luz.